Introduction
L’articulation se compose de deux tissus principaux: le cartilage articulaire et l’os sous-chondral. Le cartilage protège l’os sous-chondral des fortes contraintes, absorbe les chocs, répartit la charge et facilite le mouvement. Contrairement à d’autres tissus, le cartilage possède une capacité très limitée de régénération en raison de l’absence de vascularisation in-situ et une faible capacité de prolifération des chondrocytes. Au mieux, la cicatrisation spontanée conduit à la formation d’un fibrocartilage dont les propriétés biomécaniques sont nettement inférieures à celles du cartilage hyalin.
Les lésions cartilagineuses sont d’origine soit dégénérative, soit traumatique situées sur des zones portantes souvent chez le sujet jeune. Elles se manifestent par des douleurs persistantes, un gonflement de l’articulation, des blocages ou des accrochages et une diminution de la mobilité articulaire. En l’absence de traitement, elles peuvent évoluer vers l’arthrose ce qui est particulièrement problématique chez des patients jeunes souhaitant garder un niveau d’activités élevée [1].
Curl et al [2] ont revus 31 516 arthroscopies du genou et ont indiqué que 63% des
genoux présentaient des lésions chondrales (en moyenne 2,7 lésions/genou), 20% avaient des lésions complètes, dont 5% chez des patients âgés de moins de 40 ans. Soixante cinq pour cent des patients présentaient des lésions méniscales ou ligamentaires associées le plus souvent une rupture du ligament croisé antérieur.
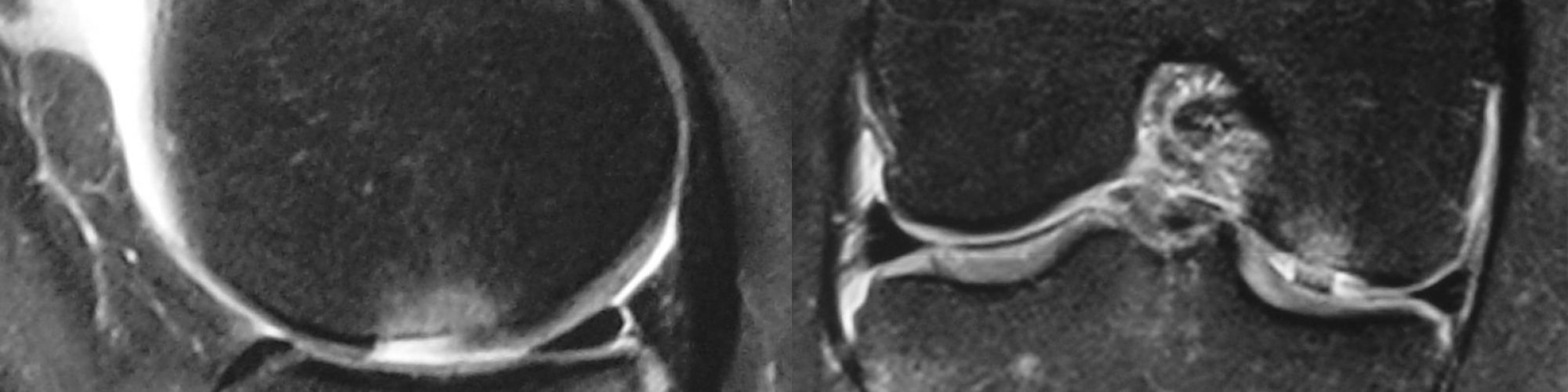
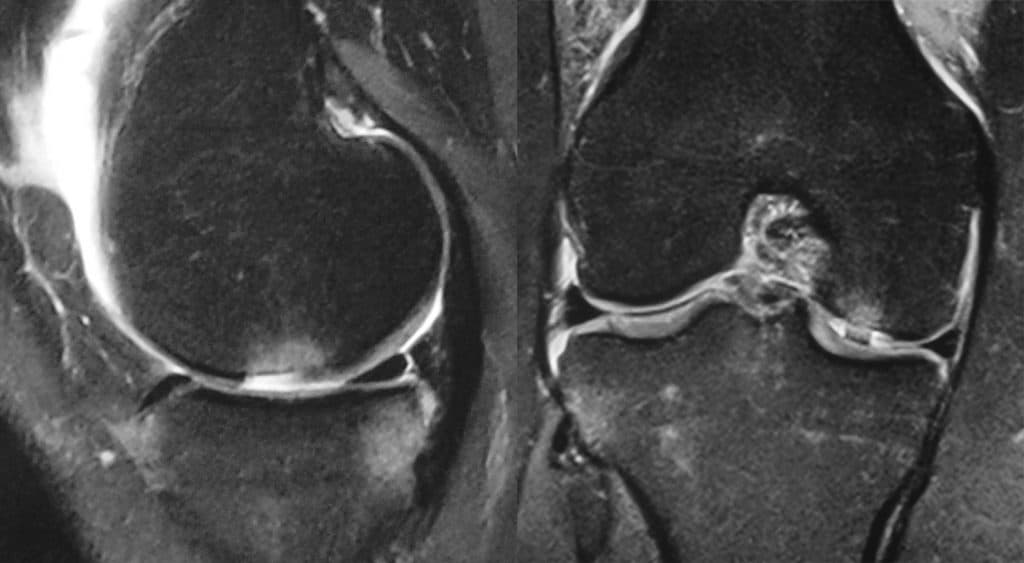
Le diagnostic est évoqué cliniquement et sur un bilan radiographique standard. L’arthroscanner, l’IRM et l’arthro-IRM permettent d’apprécier plus précisément la largeur sur les coupes frontales et la longueur sur les coupes sagittales (Fig 1). L’arthroscopie permet une évaluation de la profondeur des lésions [3]. Plusieurs classifications arthroscopiques de ces lésions ont été proposées. La plus ancienne et la plus utilisée est celle d’Outerbridge car elle est facile d’utilisation dans la pratique courante [4] (Tableau 1). La classification de l’International Cartilage Repair Society (ICRS) [5] (Tableau 1) est basée sur la profondeur de la lésion.
Les options thérapeutiques sont nombreuses. Le choix du traitement dépend de plusieurs facteurs, principalement le niveau d’activités et l’âge du patient, l’étiologie et le grade de la lésion.
Le but de cette revue bibliographique était de situer l’intérêt du débridement et des perforations arthroscopiques dans l’arsenal thérapeutique actuel.
Options thérapeutiques
Traitement conservateur
Le but de ce traitement est la réduction des symptômes et non pas la cicatrisation des lésions. Il s’agit essentiellement de : une perte de poids, une réduction des activités sportives, le port de semelles orthopédiques, la mise en décharge partielle du membre concerné, la prescription d’antalgiques et d’anti-inflammatoires, une supplémentation en calcium, voir des injections intra-articulaires de stéroïdes ou une visco-supplémentation par injection d’acide hyaluronique. Messner et Maletius [6] ont publié les résultats à plus de 14 ans de recul de 28 patients présentant une lésion cartilagineuse sévère du genou, non opérée. Les résultats cliniques étaient jugés bons à excellents chez 22 patients mais la majorité d’entre eux présentaient des anomalies radiographiques à type de pincement de l’interligne articulaire au niveau du compartiment concerné. Ce traitement est habituellement tenté en cas de lésions de petite taille, souvent de découverte fortuite, chez des patients peu ou pas symptomatiques.
Lavage arthroscopique et débridement
Ce traitement vise à réduire la douleur et l’inflammation. Le lavage articulaire le plus souvent réalisé avec du sérum physiologique permet de retirer les cellules inflammatoires, les médiateurs de l’inflammation et les fragments du cartilage. Le débridement permet en plus l’ablation des corps étrangers libres non évacués par le lavage, une synovectomie limitée et une régularisation de la surface articulaire. Le débridement est souvent réalisé avec un shaver. Jackson [7] décrit 45 % d’amélioration durable à plus de 3 ans, 35 % d’amélioration temporaire à 15 mois après un lavage arthroscopique. En cas de débridement associé, la même équipe a montré une amélioration immédiate dans 88% des cas et une amélioration durable chez 68% des patients à plus de 3 ans [8].
Techniques de stimulation sous-chondrale
Différentes techniques de stimulation sous-chondrale ont été proposées. Elles consistent à mobiliser les cellules mésenchymateuses de l’os sous-chondra,l susceptibles de se différencier en fibrochondrocytes.
Perforations de Pridie
Décrite par Pridie en 1959 [9], elle consiste à faire, à l’aide de fines mèches, de multiples perforations de la plaque sous-chondrale. Elle est encore utilisée de nos jours [10]. Cette technique expose au risque de nécrose thermique locale par le méchage motorisé. Insall [11] en 1974 a montré qu’à 6 ans de recul, le taux de succès était faible, de l’ordre de 40%.
Abrasion
Cette technique initialement décrite par Johnson dans les années 80, consiste à aviver l’os sous-chondral pour obtenir un saignement. Cette abrasion se fait avec des fraises motorisées sur un shaver. Les études ont montré que les résultats initialement bons se sont dégradés avec le temps [12, 13]. Cette technique a été abandonnée.
Microfractures
Décrite pour la première fois par Steadman [14], cette technique est réalisée sous arthroscopie avec une instrumentation spécifique (Fig. 2). Il s’agit de la technique de référence. Après un débridement des berges lésionnelles, des perforations de 3 mm de profondeur sont réalisées tous les 3 mm en partant de la périphérie vers le centre. Un saignement doit être constaté à travers ces micro-perforations. Dans les suites opératoires, si la lésion est en surface portante, l’appui est interdit pendant 6 à 8 semaines. La mobilisation passive continue sur arthromoteur est débutée très tôt, 8 heures par jour pendant 8 semaines [15]. Steadman [16] a revu 71 patients sur 73 à un recul moyen de 11,3 ans. Le défect cartilagineux moyen était de 2,79 ± 2,14 cm2. Il constate que 86% ont une fonction normale ou presque normale. 43% retournent sans restriction à leur niveau sportif, 43% ont quelques diminutions et 14% ont un niveau sportif réduit. D’autres études ont montré des résultats moins favorables à cette technique. Miethöfer [17] a évalué 52 patients opérés selon cette technique à plus de 4 ans de recul. La taille moyenne du défect était de 4,8 cm2. Alors que les résultats cliniques selon le score clinique d’ICRS était nettement améliorés dans les premiers 18 mois, une dégradation survenait ensuite. D’autres études ont également montré cette amélioration initiale suivie d’une dégradation clinique nette [18, 19]. Ceci s’explique par la composition de cartilage néoformé qui est en partie du fibrocartilage et dont les propriétés biomécaniques sont nettement inférieures à celle du cartilage hyalin-like [20].
Autogreffes ostéochondrales par mosaicoplastie
Cette technique réalisée sous arthroscopie ou à ciel ouvert, consiste à prélever des greffes ostéochondrales cylindriques au niveau d’un site donneur non portant puis de les transférer dans des puits receveurs de zones portantes percés au niveau de la zone à greffer (Fig. 3). Des cylindres de 2,7 à 8,5 mm de diamètre et de 15 à 20 mm de profondeur sont recommandés pour cette opération. Des ancillaires spécifiques permettent d’encastrer en « press-fit » les cylindres prélevés. Les études expérimentales ont montré qu’il est nécessaire de remplacer au moins 70% de la surface cartilagineuse manquante pour obtenir un bon résultat. Les études histologiques aussi bien animales que chez l’homme [21, 22] ont montré qu’environ 10 semaines après l’intervention, la zone transplantée contenait 60 à 70 % de cartilage hyalin et 30 à 40 % de fibro-cartilage, ce dernier s’étant formé à partir de l’os spongieux préalablement avivé. La morbidité du prélèvement est faible : Hangody et al. [23] rapportent dans une série rétrospective de plus de 1000 greffes en mosaïque, 3 % de morbidité avec quatre infections et 36 hémarthroses. Les contrôles arthroscopiques ont montré, par ailleurs, que les sites donneurs se recouvraient de fibrocartilage et restaient asymptomatiques dans la mesure où il s’agit de zones non portantes. Cette technique est largement pratiquée en France [10, 24]
Allogreffes ostéochondrales
Ce sont des greffes habituellement massives. En raison du risque viral, les allogreffes ne sont pas autorisées en France.
Greffes de chondrocytes autologues
Cette technique est utilisée en Suède depuis 1987 [25]. La technique est réalisée en trois temps : biopsie, culture des chondrocytes et implantation. La biopsie de cartilage sain dans une zone non portante est réalisée par arthroscopie. La culture chondrocytaire in vitro est réalisée dans un laboratoire de culture cellulaire pendant 3 semaines. Sous arthrotomie, la culture chondrocytaire est ensuite injectée sous un lambeau périosté étanche préalablement cousu sur les bords de la lésion. Une évolution de la technique consiste à ne pas réaliser de patch périosté source d’ossifications et d’arrachements [10] et d’utiliser une matrice qui sert de support à la culture des chondrocytes [26] (Fig. 4 et 5). Une rééducation active et passive est réalisée pendant 8 semaines, sans appui. Le sport est repris à 12 mois minimum. Plusieurs études ont montré l’efficacité de cette technique dans les défects cartilagineux du genou [27, 28]. Des études de cohorte ont montré que les résultats cliniques et histologiques à moyen et long terme étaient excellents, parfois à plus de 11 ans. Cependant cette technique a ses limites : une courbe d’apprentissage, un coût élevé et un taux non négligeable de complications [30]. Une vaste revue de la littérature publiée en 2010 par Cochrane Library a analysé toutes les études randomisées comparant cette technique aux autres options thérapeutiques dans le traitement des défects cartilagineux du genou [31]. Les auteurs ont conclu que d’autres études de qualité, évaluant les résultats à plus long terme, devaient être menées avant de conclure sur l’efficacité et l’innocuité de cette technique.
Algorithme décisionnel (Fig. 6)
Recommandations de la Haute Autorité de Santé
En 2005, un groupe d’expert a évalué la greffe chondrocytaire autologue du genou [32]. Celle-ci est indiquée chez les patients âgés de 15 à 50 ans, en tenant compte du niveau d’activité physique, présentant une perte de substance chondrale traumatique unipolaire symptomatique, après une prise en charge non chirurgicale, et selon la taille de la lésion. Entre 1 et 3 cm2 : mettre en balance les microfractures, l’autogreffe ostéochondrale, ou la greffe chondrocytaire autologue ; entre 3 et 8 cm2 : mettre en balance l’autogreffe ostéochondrale, ou la greffe chondrocytaire autologue et au-delà de 8 cm2 la greffe de chondrocytes n’est pas recommandée. Les contre-indications strictes sont : une lésion inférieure à 1 cm2, l’arthrose et la méniscectomie totale.
Mise au point de la Société Française d’Arthroscopie sur le traitement des pertes de substance cartilagineuses du genou en 2010
Seules les lésions symptomatiques et profondes (ICRS III et IV) doivent bénéficier d’un traitement chirurgical. L’arthrose est une contre-indication absolue. La mosaicoplastie est la technique de référence en France mais délicate à réaliser. Les microfractures sont indiquées chez les patients dont la demande fonctionnelle est faible. Les greffes de chondrocytes autologues sont à réserver aux pertes supérieures à 2 cm2.
Quelle est la place du lavage-débridement dans le traitement des lésions cartilagineuses ?
Plusieurs études ont montré l’amélioration fonctionnelle parfois durable apportée par le débridement-lavage [7, 8]. Une étude réalisée par Donzin et al a mis en évidence un élément inattendu. Cette étude devait comparer l’efficacité de la greffe de chondrocytes autologues à celle d’une mosaicoplastie [33]. Les lésions cartilagineuses étaient symptomatiques et classées stade III ou IV d’Outerbridge, sans atteinte de l’os sous-chondral. Les patients étaient randomisés entre ces deux groupes de traitement 6 mois après un débridement initial. Parmi les 44 patients sélectionnés, 14 (31,8%) patients ont été améliorés par le débridement et n’ont pas reçu le traitement initialement prévu. Ceci s’expliquait probablement par la petite taille des lésions. D’autres études randomisées comparatives sont en cours telle que l’étude ACTIVE (UK) qui compare l’efficacité des greffes de chondrocytes autologues aux techniques chirurgicales habituelles dont le débridement. Cette étude prendra fin en 2016.
Quelle est la place des perforations arthroscopiques dans le traitement des lésions cartilagineuses ?
Dans la littérature, cette technique reste la chirurgie de réparation de référence. C’est une technique simple, économique et dont les résultats initiaux sont bons. Pour la SFA [10], cette technique est à réserver aux patients à faible demande fonctionnelle, et dans les lésions non symptomatiques de découverte fortuite .de moins de 4 cm2. Pour la HAS, les microfractures sont une option à considérer pour les lésions de 1 et 3 cm2 de surface [32]. Cependant, il faut noter qu’en cas d’échec, une telle chirurgie peut compromettre la réussite ultérieure d’une greffe de chondrocytes comme l’ont montré récemment Minas et al [34]. Cette étude pourrait remettre en cause le statut de « traitement de référence » des microfractures dans l’évaluation des nouveaux traitements.
Conclusion
Malgré les recommandations des autorités de santé et des Sociétés Savantes, le traitement des lésions cartilagineuses reste encore un sujet de controverse. Le développement de nouvelles méthodes telle que les thérapies géniques, entrainera probablement dans le futur une évolution des algorithmes décisionnels.
Le débridement arthroscopique est une chirurgie conservatrice, palliative mais qui améliore la symptomatologie clinique. Elle peut être proposée en cas de petites lésions chez les patients symptomatiques et dont la demande fonctionnelle est faible.
Les microfractures est une chirurgie réparatrice indiquée dans les lésions de moins de 3cm2. La rééducation postopératoire constitue un élément important de réussite du traitement. Elle reste actuellement la technique de référence pour l’évaluation des nouveaux traitements.
Références
[1] Buckwalter JA, Mankin HJ (1998) Articular cartilage: degeneration and osteoarthritis, repair, regeneration, and transplantation. Instr Course Lect. 1998;47:487–504.
[2] Curl WW, Krome J, Gordon ES, Rushing J, Smith BP, Poehling GG (1997) Cartilage injuries: a review of 31,516 knee arthroscopies. Arthroscopy 13(4):456–460
[3] Browne JE, Branch TP (2000) Surgical alternatives for treatment of articular cartilage lesions. J Am Acad Orthop Surg 8(3):180–189
[4] Outerbridge RE (1961) The etiology of chondromalacia patella. J Bone Joint Surg Br 43:752–757
[5] Brittberg M, Peterson L (1998) Introduction of an articular cartilage classification. ICRS Newsletter;1: 5-8.
[6] Messner K, Maletius W (1996) The long-term prognosis for severe damage to weight-bearing cartilage in the knee: a 14-year clinical and radiologic follow-upon 28 young athletes. Acta Orthop Scand 67:165–168
[7] Jackson RW (1991) Arthroscopic treatment of degenerative arthritis. In: McGinty JB (ed) Operative arthroscopy. New York, Raven Press, pp 319–323
[8] Jackson RW, Marans HJ, Silver RS (1998) Arthroscopic treatment of degenerative arthritis of the knee. J Bone Joint Surg Br 70:332
[9] Pridie KH (1959) A method of resurfacing osteoarthritic knee joint. J Bone Joint Surg 41B:618
[10] Versier G, Dubrana F; French Arthroscopy Society (2011) Treatment of knee cartilage defect in 2010. Orthop Traumatol Surg Res.;97(8 Suppl):S140-53.
[11] Insall JN (1974) The Pridie debridement operation for osteoarthritis of the knee. Clin Orthop Relat Res. (101):61-7.
[12] Johnson LL (1986) Arthroscopic abrasion arthroplasty historical and pathologic perspective: present status. Arthroscopy.;2(1):54-69.
[13] Bert J,Maschka K (1989) The arthroscopic treatment of unicompartmental gonarthrosis: a five year follow-up study of abrasion arthroplasty plus arthroscopic debridement and arthroscopic debridement alone. Arthroscopy; (1):25-32.
[14] Steadman JR, Rodkey WG, Singleton SB, et al (1997) Microfracture technique for fullthickness chondral defects: technique and clinical results. Oper Tech Orthop 7:300-4.
[15] Steadman JR, Rodkey WG, Rodrigo JJ (2001) Microfracture: surgical technique and rehabilitation to treat chondral defects. Clin Orthop Relat Res. 2001 Oct;(391 Suppl):S362-9.
[16] Steadman JR, Briggs KK, Rodrigo JJ, Kocher MS, Gill TJ, Rodkey WG (2003) Outcomes of microfracture for traumatic chondral defects of the knee: average 11-year follow-up. Arthroscopy. 19(5):477-84.
[17] Mithoefer K, Williams RJ, Warren RF, et al. The microfracture technique for the treatment of articular cartilage lesions in the knee. A prospective cohort study. J Bone Joint Surg Am. 2005 87(9):1911−20
[18] Kreuz PC, Erggelet C, Steinwachs MR, et al (2006) Is microfracture of chondral defects in the knee associated with different results in patients aged 40 years or younger? Arthroscopy. 22(11):1180−6
[19] Steinwachs MR, Guggi T, Kreuz PC (2008) Marrow stimulation techniques. Injury 39 Suppl 1:S26-31.
[20] Frisbie DD, Oxford JT, Southwood L, Trotter GW, Rodkey WG, Steadman JR, Goodnight JL, McIlwraith CW (2003) Early events in cartilage repair after subchondral bone microfracture. Clin Orthop Relat Res.(407):215-27.
[21] Hangody L, Kish G, Kárpáti Z, et al (1997) Autogenous osteochondral graft technique for replacing knee cartilage defects in dogs. Orthop Int 5: 1
[22] Hangody L, Kish G, Kárpáti Z, Szerb I<span lang= »EN-GB » style= »line-height: 200%; font-family: ‘A</body></html>
Docteur Nicolas LEFEVRE, Docteur Yoann BOHU, Docteur Shahnaz KLOUCHE , Docteur Serge HERMAN. – 23 octobre 2013.